Olá moçada! A seguir há um vídeo explicativo sobre as mudanças de estados físicos. Qualquer dúvida pergunte-nos através do "contato".
Recapitulando:
Essa imagem e uma síntese da mudança de estados físicos mostrado no vídeo.
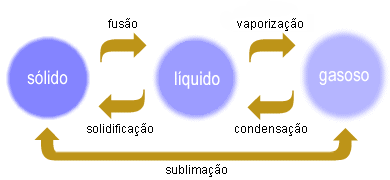
não podemos esquecer que para haver essas mudanças a matéria sofre influencia de algum fator externo, principalmente, temperatura e pressão.
- fusão e vaporização: ocorrem com o aquecimento da matéria
- solidificação e condensação: ocorrem com o resfriamento da matéria
- Tem 3 tipos de vaporização: ebulição, calefação, evaporação.
Endotérmicas: sistema que recebe calor. ex: fusão, vaporização
Exotérmicas: sistema que libera calor. ex: condensação, solidificação
Então é isso moçada!! espero que vocês tenham aprendido sobre as mudanças de estado físico!! Até a próxima.
Grupo: Thais Dzenk, Paula Moreira, Carolina Braga, Aulus Pinho, Matheus Henrique











